*مینا*
کاربر فعال شیمی
پیلهای الکتروشیمیایی ابزاری برای تبدیل انرژی الکتریکی و شیمیایی به یکدیگر بوسیله واکنشهای الکتروشیمیایی هستند، بدین دلیل به اسم پیلهای الکتروشیمیایی معروفند.
مقدمه
هنگامی که چراغ قوه را روشن کنید یا برای روشن شدن خودرو استارت میزنید از انرژی الکترکی استفاده میکنید. این انرژی توسط دستهای از واکنشهای شیمیایی فراهم میشود که در باتریها روی میدهد. مطالعه شیمی باتریها و مباحثی برقکافت ، آبکاری ، فلز گری و از همه مهمتر خوردگی که در چالش برانگیزترین مسأله در جوامع صنعتی امروز به شمار میآید همگی در نتیجه واکنشهای الکتروشیمیای مطرح میشوند.
تاریخچه
الکساندر ولتا (1827 - 1745) فیزیکدان ایتالیایی و مخترع اولین باتری است که اکنون پیل ولتا نامیده میشود. این پیل شامل صفحات متناوبی از مس و روی است که توسط صفحات مقوایی نازک که در محلول نمکی غوطهورند از هم جدا شدهاند، بخاطر کمک او به علم الکتریسیته ، واحد اختلاف پتانسیل الکتریکی (ولت) به نام اوست.
نقش و تأثیر در زندگی
باتریهای خشک در زندگی روزمره برای مصارف گوناگون بکار میروند، سلولهای انبارهای که شامل باتری خودرو باشند برای راه اندازی اتومبیلها بکار میروند، از باتریهای نیکل - کادمیم در ابزاری مانند تلفن بی سیم ، رایانههای قابل حمل (لپ تاپ) ، تلفن همراه و ماشینهای اصلاح استفاده میشود و سلولهای سوختی برای تأمین برق و آب آشامدنی فضاپیما استفاده میشود و برای تأمین برق بیمارستانها و به تازگی تأمین نیروی محرکه وسایل نقلیه سنگین و سبک هم استفاده میشود. خوردگی سالانه خسارات زیادی در صنعت به بار میآورد.
ساختار یا ساختمان
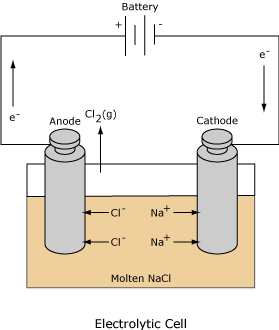
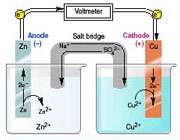
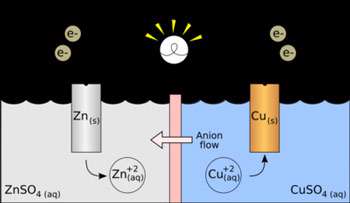
یک پیل الکتروشیمیایی از دو الکترود جریان به نام الکترود کاتد و آند تشکیل یافته است، به هر یک از این الکترودها که در محلول الکترولیت قرار گرفتهاند و محلولهای الکترولیتی در صورت متفاوت بودن از نظر ترکیب شیمیایی توسط یک پیل نمی که لولههای شیشهای نعلی شکل پر شده از محلول غلیظ یک الکترولیت قدیمی باشند و یا یک دیواره متخلخل (نظیر شیشه گداخته و یا چینی و سرامیک بدون لعاب) باهم ارتباط دارند. پیهای الکتروشیمیایی بطور قرار دادی به دو نوع پیل گالوانیک (ولتایی) و الکترولیزی تقسیم میشوند.

طرز کار و مکانیزم کار
پیلهای الکتروشیمیایی با واکنشهای اکسایش - کاهش: واکنشهای اکسایش- کاهش عبارتند از انتقال الکترون از یک واکنشگر به واکنشگر دیگری. واکنش اکسایش - کاهش از دو نیم واکنش تشکیل یافته است، نیم واکنشی که در آن واکنشگر الکترون از دست میدهد نیم واکنش اکسید است و در آند رخ میدهد و واکنشگر را کاهنده یا احیا کننده پیلهای الکتروشیمیایی مینامند. نیم واکنشی که در آن واکنشگر الکترون میگردد، نیم واکنش احیا یا کاهش میباشد و در کاتد رخ میدهد و واکنشگر را اکسید کننده یا اکسنده مینامند و پتانسیل واکنش را میتوان با استفاده از معادله ارنست محاسبه کرد.
کاربردها
از پیلهای الکتروشیمیایی میتوان در موارد زیر استفاده نمود:
چشم انداز و آینده بحث
مواد قابل سنجش متعددی در هوا ، آب ، خاک و دیگر تشکیل دهندههای محیط زیست وجود دارد و هر روز بر تعداد اینگونه مواد افزوده میشود. ضرورت اندازه گیری آلایندههایی نظیر انواع حشره کشها ، کودهای شیمیایی ، زبالهها و پسابهای صنعتی و خانگی بر کسی پوشیده نیست. با استفاده از پیلها و اندازه گیری پتانسیل آنها به ویژه زیست حسگرها میتوان کلیه امور را در مدت زمان کم و به آسانی انجام داد.
منبع :: دانشنامه رشد
مقدمه
هنگامی که چراغ قوه را روشن کنید یا برای روشن شدن خودرو استارت میزنید از انرژی الکترکی استفاده میکنید. این انرژی توسط دستهای از واکنشهای شیمیایی فراهم میشود که در باتریها روی میدهد. مطالعه شیمی باتریها و مباحثی برقکافت ، آبکاری ، فلز گری و از همه مهمتر خوردگی که در چالش برانگیزترین مسأله در جوامع صنعتی امروز به شمار میآید همگی در نتیجه واکنشهای الکتروشیمیای مطرح میشوند.

تاریخچه
الکساندر ولتا (1827 - 1745) فیزیکدان ایتالیایی و مخترع اولین باتری است که اکنون پیل ولتا نامیده میشود. این پیل شامل صفحات متناوبی از مس و روی است که توسط صفحات مقوایی نازک که در محلول نمکی غوطهورند از هم جدا شدهاند، بخاطر کمک او به علم الکتریسیته ، واحد اختلاف پتانسیل الکتریکی (ولت) به نام اوست.
نقش و تأثیر در زندگی
باتریهای خشک در زندگی روزمره برای مصارف گوناگون بکار میروند، سلولهای انبارهای که شامل باتری خودرو باشند برای راه اندازی اتومبیلها بکار میروند، از باتریهای نیکل - کادمیم در ابزاری مانند تلفن بی سیم ، رایانههای قابل حمل (لپ تاپ) ، تلفن همراه و ماشینهای اصلاح استفاده میشود و سلولهای سوختی برای تأمین برق و آب آشامدنی فضاپیما استفاده میشود و برای تأمین برق بیمارستانها و به تازگی تأمین نیروی محرکه وسایل نقلیه سنگین و سبک هم استفاده میشود. خوردگی سالانه خسارات زیادی در صنعت به بار میآورد.
ساختار یا ساختمان
یک پیل الکتروشیمیایی از دو الکترود جریان به نام الکترود کاتد و آند تشکیل یافته است، به هر یک از این الکترودها که در محلول الکترولیت قرار گرفتهاند و محلولهای الکترولیتی در صورت متفاوت بودن از نظر ترکیب شیمیایی توسط یک پیل نمی که لولههای شیشهای نعلی شکل پر شده از محلول غلیظ یک الکترولیت قدیمی باشند و یا یک دیواره متخلخل (نظیر شیشه گداخته و یا چینی و سرامیک بدون لعاب) باهم ارتباط دارند. پیهای الکتروشیمیایی بطور قرار دادی به دو نوع پیل گالوانیک (ولتایی) و الکترولیزی تقسیم میشوند.

طرز کار و مکانیزم کار
پیلهای الکتروشیمیایی با واکنشهای اکسایش - کاهش: واکنشهای اکسایش- کاهش عبارتند از انتقال الکترون از یک واکنشگر به واکنشگر دیگری. واکنش اکسایش - کاهش از دو نیم واکنش تشکیل یافته است، نیم واکنشی که در آن واکنشگر الکترون از دست میدهد نیم واکنش اکسید است و در آند رخ میدهد و واکنشگر را کاهنده یا احیا کننده پیلهای الکتروشیمیایی مینامند. نیم واکنشی که در آن واکنشگر الکترون میگردد، نیم واکنش احیا یا کاهش میباشد و در کاتد رخ میدهد و واکنشگر را اکسید کننده یا اکسنده مینامند و پتانسیل واکنش را میتوان با استفاده از معادله ارنست محاسبه کرد.
کاربردها
از پیلهای الکتروشیمیایی میتوان در موارد زیر استفاده نمود:
- تعیین PH محیط واکنش و ثابت تعادل واکنش
- در صنعت نانو برای رسوب گیری مواد بر روی الکترودها
- در ساخت و کاربرد حسگرها مورد استفاده در تشخیص و اندازه گیری گونههای زیستی یعنی زیست حسگرها
- در صنعت پزشکی برای رسم الکتروکار دیاگرام
چشم انداز و آینده بحث
مواد قابل سنجش متعددی در هوا ، آب ، خاک و دیگر تشکیل دهندههای محیط زیست وجود دارد و هر روز بر تعداد اینگونه مواد افزوده میشود. ضرورت اندازه گیری آلایندههایی نظیر انواع حشره کشها ، کودهای شیمیایی ، زبالهها و پسابهای صنعتی و خانگی بر کسی پوشیده نیست. با استفاده از پیلها و اندازه گیری پتانسیل آنها به ویژه زیست حسگرها میتوان کلیه امور را در مدت زمان کم و به آسانی انجام داد.
منبع :: دانشنامه رشد
آخرین ویرایش توسط مدیر:

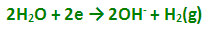
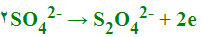
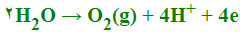
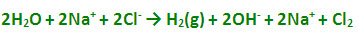

 کلی عذر
کلی عذر 