قدم اول : شناخت اعداد کوانتومی
n = عدد کوانتومی اصلی
نشان دهنده : لایه اصلی , تعداد زیر لایه ها , سطح انرژی لایه ها , اندازه اوربیتال ها
n = از 1 تا حداکثر 7
پیدا کردن تعداد اوربیتال و الکترون در لایه اصلی
تعداد اوربیتال در لایه اصلی = n2
تعداد الکترون در لایه اصلی = 2n2
L= عدد کوانتومی اوربیتالی
نشان دهنده : زیر لایه , شکل اوریتال , تعداد اوربیتال
L = 0 ... n-1
(یعنی L از صفر شروع میشه تا n-1 )
0=s
1=p
2=d
3=f
پیدا کردن تعداد اوربیتال و الکترون در زیر لایه
تعداد اوربیتال در هر زیر لایه = 2L+1
تعداد الکترون در هر زیر لایه = 4L+2
ml = عدد کوانتومی مغناطیسی
نشان دهنده : جهت اوربیتال در فضا
قدم دوم : شناخت دوره و روش تعیین آن
دوره = به هر ردیف افقی از چپ به راست یک دوره یا تناوب گفته میشود
دوره در آرایش الکترونی = بزرگترین n در آرایش الکترونی
برای نوشتن آرایش الکترونی عناصر با عدد اتمی بالا (زیاد) باید عدد اتمی گاز نجیب در
دوره قبل رو از عدد اتمی عنصر مورد نظر کم کنید تا نوشتن آرایش لایه ظرفیت راحت تر
بشه.
گازهای نجیب :
2He
10Ne
18Ar
36Kr
54Xe
86Rn
دوره = شماره گاز نجیب +1
جدول تناوبی 7 دوره دارد :
دوره اول 1s
دوره دوم 2s 2p
دوره سوم 3s 3p
دوره چهارم 4s 3d 4p
دوره پنجم 5s 4d 4p
دوره ششم 6s 4f 5d 6p
دوره هفتم ناقص (کاری باهاش نداریم)
>>> به پر شدن اوربیتالها بعد از دوره سوم دقت کنید.
قدم سوم : نوشتن آرایش الکترونی
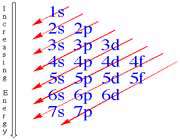
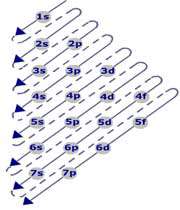
ترتیب پرشدن زیر لایه ها بر اساس پایداری = ... 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
ترتیب نوشتن بر اساس سطح انرژی = 1s , 2s 2p , 3s 3p 3d , 4s 4p 4d 4f
- وقتی عدد اتمی عنصر مورد نظر رو از عدد اتمی گاز نجیب در دوره قبل کم کردین عدد بدست
اومده میشه تعداد الکترون لایه ظرفیت.
که اون رو بعد از پیدا کردن دوره عنصر اصلی و در نظر گرفتن لایه های هر دوره طبق چیزایی که
بالا نوشتم در زیر لایه قرار میدین و به این ترتیب آرایش الکترونی لایه ظرفیت بدست میاد.