*مینا*
کاربر فعال شیمی
الکترونگاتیویته Electronegativity میزان توانایی نسبی یک اتم در یک مولکول برای جذب جفت الکترون پیوندی بسوی خود است.
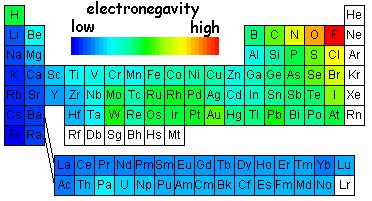
متداولترین مقیاس الکترونگاتیویته
مقیاس نسبی الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی б+ و б- اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق б و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد. در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد 4 نسبت داده شده است.
مقیاس الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوند است. مثلا انرژی پیوند Br-Br ، انرژی لازم برای تفکیک مولکول Br2 به اتمهای Br است. برای تفکیک یک مول از مولکولهای Br2 به اندازه 46+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر 104+ کیلو کالری بر مول است.
تعاریف مختلف الکترونگاتیویته
الکترونگاتیویته ، در روشهای متفاوتی تعریف شده است که برخی از آنها به اختصار توضیح داده میشود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B میتواند به حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B بطور قابل ملاحظه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد، میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد.
الکترونگاتیویته آلرد_روکر
در این تعریف ، الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس میکند. بر طبق این تعریف ، عناصری با الکترونگاتیویته بالا آنهایی هستند که با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک ، این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توزیع دوباره الکترون در طی تشکیل تر کیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
اگر یک اتم دارای انرژی یونیزاسیون بالا و الکترونخواهی بالا باشد، احتمالا در هنگام تشکیل پیوند ، الکترونها را به سوی خود میکشد. بنابراین بعنوان الکترونگاتیو شناخته میشود. از طرف دیگر اگر انرژی یونش و الکترونخواهی آن ، هر دو کوچک باشد تمایل دارد تا الکترون از دست بدهد. بنابراین به عنوان الکترو پوزیتیو طبقه بندی میشود.
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی میکند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و همچنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد. فلزات ، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آنها حاکم است، ولی نافلزات ، به استثنای گازهای نجیب ، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آنها زیاد است.
بطور کلی ، الکترونگاتیوی عناصر در هر دوره از چپ به راست (با افزایش تعداد الکترونهای والانس) و در هر گروه از پایین به بالا (با کاهش اندازه اتم) افزایش مییابد. بنابراین ، الکترونگاتیوترین عناصر ، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات ، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی همجهت است.
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است، ولی دقیق نیست. روشی ساده و مستقم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روشهای گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتمهای متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم نامتغیر نیست.
انتظار میرود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از اینرو ، این مفهوم را تنها بایستی نیمهکمی تلقی کرد. بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی میشود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آنها خیلی زیاد نباشد. در اینگونه موارد، اختلاف الکترونگاتیوی عناصر نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است. اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند اساسا غیر قطبی است و اتمهای مربوط ، سهم مساوی یا تقریبا مساوی در الکترونهای پیوند دارند.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که HF قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل میشود، پیوند فلزی و در آن اختلاف الکترونگاتیوی نسبتا کم است.
کاربردهای الکترونگاتیویته
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد. بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
منبع :: دانشنامه رشد

متداولترین مقیاس الکترونگاتیویته
مقیاس نسبی الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی б+ و б- اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق б و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد. در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد 4 نسبت داده شده است.
مقیاس الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوند است. مثلا انرژی پیوند Br-Br ، انرژی لازم برای تفکیک مولکول Br2 به اتمهای Br است. برای تفکیک یک مول از مولکولهای Br2 به اندازه 46+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر 104+ کیلو کالری بر مول است.
تعاریف مختلف الکترونگاتیویته
الکترونگاتیویته ، در روشهای متفاوتی تعریف شده است که برخی از آنها به اختصار توضیح داده میشود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B میتواند به حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B بطور قابل ملاحظه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد، میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد.
الکترونگاتیویته آلرد_روکر
در این تعریف ، الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس میکند. بر طبق این تعریف ، عناصری با الکترونگاتیویته بالا آنهایی هستند که با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک ، این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توزیع دوباره الکترون در طی تشکیل تر کیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
اگر یک اتم دارای انرژی یونیزاسیون بالا و الکترونخواهی بالا باشد، احتمالا در هنگام تشکیل پیوند ، الکترونها را به سوی خود میکشد. بنابراین بعنوان الکترونگاتیو شناخته میشود. از طرف دیگر اگر انرژی یونش و الکترونخواهی آن ، هر دو کوچک باشد تمایل دارد تا الکترون از دست بدهد. بنابراین به عنوان الکترو پوزیتیو طبقه بندی میشود.
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی میکند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و همچنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد. فلزات ، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آنها حاکم است، ولی نافلزات ، به استثنای گازهای نجیب ، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آنها زیاد است.
بطور کلی ، الکترونگاتیوی عناصر در هر دوره از چپ به راست (با افزایش تعداد الکترونهای والانس) و در هر گروه از پایین به بالا (با کاهش اندازه اتم) افزایش مییابد. بنابراین ، الکترونگاتیوترین عناصر ، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات ، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی همجهت است.
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است، ولی دقیق نیست. روشی ساده و مستقم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روشهای گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتمهای متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم نامتغیر نیست.
انتظار میرود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از اینرو ، این مفهوم را تنها بایستی نیمهکمی تلقی کرد. بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی میشود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آنها خیلی زیاد نباشد. در اینگونه موارد، اختلاف الکترونگاتیوی عناصر نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است. اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند اساسا غیر قطبی است و اتمهای مربوط ، سهم مساوی یا تقریبا مساوی در الکترونهای پیوند دارند.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که HF قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل میشود، پیوند فلزی و در آن اختلاف الکترونگاتیوی نسبتا کم است.
کاربردهای الکترونگاتیویته
- میتوان برای تعیین میزان واکنش پذیری فلزات و غیر فلزات بکار برد.
- میتوان برای پیشبینی خصلت پیوندهای یک ترکیب بکار برد. هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود 1.7 باشد، خصلت یونی نسبی پیوند بیش از 50% است.
- اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها ، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
- با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونیسدیم و کلر 2.1 است و NaCl یک ترکیب یونی است. حاصل میشود. مثلا اختلاف الکترونگاتیوی
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد. بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
منبع :: دانشنامه رشد

 اکترونگاتیوه
اکترونگاتیوه