*مینا*
کاربر فعال شیمی
تولد یک دانشمند ارنست رادرفورد در 30 آگوست 1871 درحومه برايت واتر شهر نلسون واقع در ساحلشمالي جزيره جنوبي زلاندنو به دنيا آمد. اوچهارمين فرزند از دوازده فرزند جيمز و مارتارادرفورد نيوزلنديهاي نسل اول بود كه ازكودكي از اسكاتلند به زلاندنو آمده بودند.خانواده رادرفورد معتقد به مسيحيت و با فرهنگو جدي در رفتن به كليسا بودند. آنها احساسخوشبختي ميكردند و اين خانواده پرجمعيتچهارده نفري در انجام كارهاي روزمره خانوادهشركت ميكردند. پدر و مادر سعي در ارتقايسطح علمي فرزندانشان داشتند. آنها عليرغماينكه در كشاورزي فعاليت داشتند و ساعتهايمتمادي مجبور به كار در مزرعه خود بودند، دستاز مطالعه كتب مذهبي و علمي برنميداشتند. از اين رو ارنست نيز همچون والدينش بهتحصيل علم علاقمند بود. عشق او به علم در اوانكودكي بروز كرد. در سن ده سالگي كتب علميهمچون خواندنيهاي اوليه فيزيك و شيمي را كهتاليف معلمي به نام بالفور استوارت بود با علاقه وجديت مطالعه ميكرد. كتاب استوارت شبيهكتابهاي خودآموز فيزيك امروزي بود كه درآن اصول اوليه و پايهاي فيزيك را با زبان سادهتوضيح داده بود. ارنست نيز اين كتاب را بيش از15 بار مطالعه كرد و با اجسام سادهاي همچونشمع، سنگ، سكه و وسايل آشپزخانه مادرشآزمايشهاي اين كتاب را انجام داد. او در همانشهر به مدرسه رفت.
16 ساله بود كه نخستين بورس از بورسهايتحصيلي متعدد در زندگي خود را دريافت كرد وتوانست در كالج كنتر بوري شهر كريست چرچثبتنام كند. او رشته تحصيلي اصلي خود رافيزيك و رياضيات انتخاب كرد و تحت نظر اساتيدباتجربه كالج به فراگيري اين علوم پرداخت.
او در مدت 3 سال مدرك كارشناسي رياضيفيزيك گرفت و براي ارايه پايان نامه خود دومقاله مهم درباره فعاليت تشعشعي مواد در سال1895 نوشت كه مقالاتش مقام دوم را از آنخود كرد. يكي ديگر از جوايز او حق انتخابموسسه آموزشي براي ارتقاي سطح علمي بود كهرادرفورد آزمايشگاه كاونديش در دانشگاهكمبريج لندن را برگزيد. اين آزمايشگاه بهمديريت جيجي تامسون صاحب نظر پيشتازجهان در زمينه الكترو مغناطيس اداره ميشد. اينفرد صاحبنام تاثير زيادي در روند پيشرفتارنست داشت و او را حمايت و تشويق كرد.
اکتشافات علمی
ارنست در دوران تحصيل خود با اكتشافاتمهمي از جمله كشف اشعه ايكس توسط ويلهمكنراد رونتگن فيزيكدان آلماني روبهرو شد وهمين كشفها در زندگي علمي او تاثير زياديگذاشت.
كشف مهم ديگر درباره تحقيقات هانري بكرلدانشمند فرانسوي بود كه تاثير نور مرئي و سنگمعدن اورانيوم برروي فيلم عكاسي را فهميد.
رادرفورد در سال 1895 كار جدي خود رادر آزمايشگاه كاونديش آغاز كرد و راديواكتيويتهناهمانند را مورد شناسايي قرار داد. او اوليناشعهاي كه بار الكتريكي مثبت داشت و به سهولتدر مواد جذب ميشد را اشعه آلفا ناميد و اشعهدوم با بار الكتريكي منفي را اشعه بتا نام گذاشت
او اشعه سومي را هم يافت كه شبيه پرتوهايايكس بود. رادرفورد طي شبانه روز فقط 3ساعت ميخوابيد و تمام ساعات شب و روز را درآزمايشگاه ميگذراند حتي وقت استحمام كردنهم نداشت. او در نهايت اظهار كرد كه راديوم تنهاعنصر از گروه عناصر حاصل از فعاليت تشعشعياورانيوم است.
رادرفورد در سال 1903 مفتخر به عضويتانجمن سلطنتي لندن شد و يك سال بعد كتابي درزمينه (فعاليت تشعشعي) نوشت. امروزه اين كتابجزو كتب كلاسيك ميباشد.
رادرفورد به شهرت رسيده بود و از سويچندين دانشگاه هندي كرسيهاي زيادي به ويپيشنهاد شد. او تصميم گرفت در دانشگاه منچسترمشغول به كار شود. ارنست در اين دانشگاه استادعدهاي از دانشجوياني بود كه درباره ساختار اتمتحقيق ميكردند رادرفورد در سال 1907 تلاشو كوشش زيادي جهت شناخت ساختار اتم داشتلذا از سوي دانشگاه چندين نشان و جايزهدريافت كرد و در همان سال مفتخر به دريافتجايزه نوبل در رشته شيمي شد. به گفته رادرفورد،سال 1907 اوج شكوفايي شهرت و موفقيت ويبوده است.
بزرگترين نتيجه كاري رادرفورد كشف ساختارهسته اتم بود. او تا آن زمان تصور ميكرد اتمجسمي سخت و قرمز است اما با تحقيق و بررسيفهميد كه اتم متشكل از ذرات بيشمار ميباشد كههر ذره اسراري را در دل دارد.
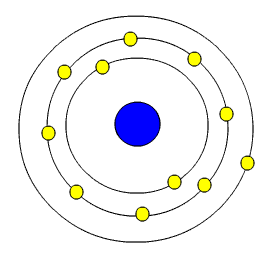
مدل اتمی رادرفورد
قبل از رادرفورد چند دانشمند درباره ساختاراتم تحقيقاتي انجام داده بودند اما رادرفورد بههمه نظريهها جامه عمل پوشاند و آنها كامل نمود.
او معتقد بود كه يك هسته در مركز اتم وجوددارد. بيشترين جرم و تمام بار مثبت اتم در هستهمتمركز است. هسته شامل پروتونها ونوترونهايي است كه هم جرم هسته را دربردارند و هم بار هسته ناشي از پروتونهاي آناست. او بر اين ايده بود كه هسته درون اتمداراي بار مثبت است كه توسط الكترونهامحاصره شده و به خاطر وجود فضاي خالي زياددرون اتم حجمش كم ميباشد. رادرفورد اينفيزيكدان بزرگ و آزمايشگري كه به پشتكاري اوتاكنون فردي نيامده است نام پدر انرژي هستهايرا به نام خود ثبت كرد.
رادرفورد با كشف هسته اتم راه را برايدانشمندان آينده خود هموار كرد.
دانشمندان با توجه به مجموعه آزمايشهايرادرفورد به اين نتيجه رسيدند كه اتمها برخلافنامشان از اجزاي كوچكتري هم تشكيل شدهاندرادرفورد از سوي انجمن سلطنتي انگلستان بهلقب لرد رادرفورد نايل شد.
در حقيقت بعد از اينكه رادرفورد ماهيتتشعشع راديواكتيو را كشف كرد دانشمندان پيبردند كه راديواكتيويته به علت متلاشي شدنخود به خود هستههاي سنگين و تبديل آنها بههستههاي سبكتر است. در ميان اين تبديل وتحول ذرات آلفا، بتا و گاما ساطع ميشود و بهدنبال آن ماهيت آن تغيير ميكند. رادرفورد ازاين طريق توانست نيمه عمر را معنا بخشد وي سهمزيادي در شناخت اتم همچنين انرژي هستهايدارد كه امروزه از آن در جوامع جهان به وفور ازآن ياد ميشود. در واقع رادرفورد اسرار ناگفتهاتم را براي همگان گشود و كشف كرد.
زندگی شخصی رادرفورد
ارنست رادرفورد همه اوقات زندگي خود رادر راه كشفهاي علمي خود گذاشت و به ازدواجو تشكيل خانواده فكر نكرد.
روزهاي متمادي در آزمايشگاهش مشغولتحقيق بر روي ذرات اتم بود و يا كتاب و مقالهمينوشت. هفتهها پي در پي ميگذشت و حتييك بار به بيرون از آزمايشگاه پا نميگذاشت و نورخورشيد را نميديد. از اين رو هيچگاه به داشتنيك زندگي مشترك فكر نكرد. او خودش را وقفعلم فيزيك و شيمي كرده بود و در آن غرق شدهبود.
در سالهاي اوليهاي كه نظريه خود را در زمينههسته اتم ارايه كرد هوادار چنداني نداشت. اماكمكم توانست ايدهاش را به همگان بقبولاند ومورد اعتماد واقع شود.
يكي از همكاران و شاگردانش، فردريكسودي در دانشگاه مك گيل بود كه با كمك و ياريرادرفورد كاشف ايزوتوپها شد. اوتوهانآلماني يكي ديگر از شاگردان وي بود كه 30 سالبعد با شكاف اورانيوم و اظهار اينكه در هر اتمهمواره انرژي وجود دارد، استاد خود را مبهوتكرد.ارنست رادرفورد در سال 1927درگذشت.
آخرین ویرایش توسط مدیر: